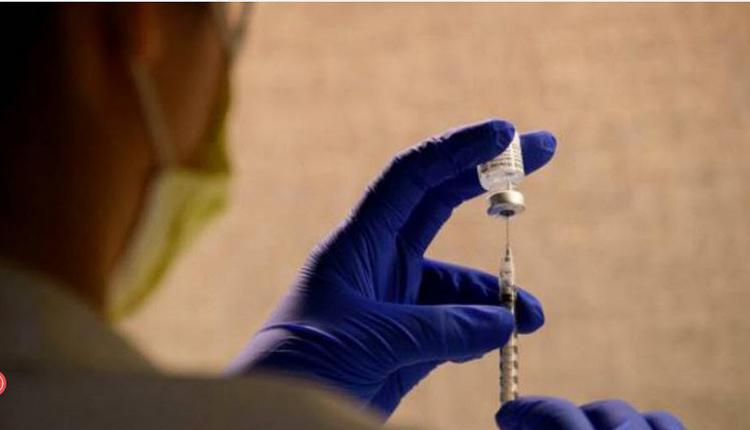
港媒22日报导称,中国预计在2021年2月15日之前为5,000万人接种COVID-19国产疫苗。报导提醒,在大规模接种之前,中国当局必须讲清楚关于疫苗的相关问题。
据健康时报报导,原上海疾控中心免疫规划科疫苗医师陶黎纳表示,中国首批COVID-19疫苗预计接种5000万人次,首针将于1月15日接种完成,第二针将于2月15日完成。
目前中国接种疫苗的策略是先对部分重点人群开展接种,包括从事进口冷链、口岸检疫、船舶引航、航空空勤、生鲜市场、公共交通、医疗疾控等感染风险比较高的工作人员和前往中高风险国家或者地区去工作或者学习的人员。
据香港01报导,目前已有10多个国家和地区向中国订购了5亿的COVID-19疫苗。阿联酋和巴林先后批准了中国国药集团生产的COVID-19疫苗在本国上市。
报导称,不过外界对中国的疫苗抱有警惕,西方媒体在谈及中国疫苗时认为它“不透明”。就连采购中国疫苗的巴西国家卫生监督局14日也发文表示:“克尔来福(疫苗的名字)自6月起在中国获得紧急使用授权。但是中国批准紧急使用授权的标准不透明,因此无法获知中国做出相关决定所依据的标准信息。”
土耳其前总理达夫托葛鲁(Ahmet Davutoğlu )接受Karar TV专访时称:“我无法轻易的去相信中国制造的疫苗,毕竟中国所有科学研究都遭到中国政府的操控。”
自由亚洲电台曾报导,12月中旬安哥拉、塞尔维亚有大量中国员工感染COVID-19。让人担忧的是,这些患者在出境前都注射了中国国药集团生产的COVID-19疫苗。报导特指塞尔维亚的一个项目组,在这里约有员工400多人,感染者超过300人。
中国批准疫苗紧急使用授权 究竟哪里“不透明”?
香港01称,现在全球对疫苗的需求异常迫切,西方多国先后批准了辉瑞、莫得纳(Moderna)疫苗的紧急使用授权。与西方相比,中国批准的疫苗紧急使用授权到底哪里“不透明”呢?
中国2019年通过的《疫苗管理法》第十九条规定:在中国境内上市的疫苗应当经国务院药品监督管理部门批准,取得药品注册证书;申请疫苗注册,应当提供真实、充分、可靠的数据、资料和样品。
第二十条规定:应对重大突发公共卫生事件急需的疫苗,或者国务院卫生健康主管部门认定急需的其他疫苗,经评估获益大于风险的,国务院药品监督管理部门可以附条件批准疫苗注册申请。出现特别重大突发公共卫生事件或者其他严重威胁公众健康的紧急事件,国务院卫生健康主管部门根据传染病预防、控制需要提出紧急使用疫苗的建议,经国务院药品监督管理部门组织论证同意后可以在一定范围和期限内紧急使用。
第二十一条规定:国务院药品监督管理部门在批准疫苗注册申请时,对疫苗的生产工艺、质量控制标准和说明书、标签予以核准。国务院药品监督管理部门应当在其网站上及时公布疫苗说明书、标签内容。
香港01在报导中称,西方国家同样要求制药公司在申请疫苗上市前需要提供相关资料。欧盟药监局要求疫苗制造商或者研发者向欧洲药品监管机构提交所有的试验结果;美国FDA要求疫苗申请者提供包含I期和II期临床试验所有的数据,和1个超过3,000多名疫苗接种者的第三阶段临床试验的安全数据库。
中国官方声称疫情基本得到控制,所以三期临床试验基本是在中国以外的国家进行的。根据中国的相关规定,阿联酋公布的国药集团疫苗86%的有效率,是可以做为参考使用的。
中国国家卫生健康委科技发展中心主任、国务院联防联控机制科研攻关组疫苗研发专班工作组组长郑忠伟称,中国生物在北京和武汉两个生物制品研究所研发的COVID-19灭活疫苗,及北京科兴中维生物技术有限公司开发的COVID-19灭活疫苗克尔来福在7月22日获得了紧急使用授权,但是早在7月16日阿联酋就已经和国药集团开始了COVID-19疫苗三期临床试验,7月21日克尔来福疫苗在巴西启动三期试验。
也就是说在三期试验刚刚启动时,中国当局就开始批准使用。而美欧等国家是等到辉瑞和莫得纳等疫苗生产商公布三期试验数据后,认为疫苗有效才予以紧急批准。相比之下引发外界质疑,中国批准使用的数据来源于何处?是否只需要得到中国国务院药品监督管理部门的同意即可?
另外,香港01认为,中国药品监督管理部门应当在其网站上及时公布疫苗的说明书、标签内容。但是直到今天,网站上没有相关信息。
中国国药集团有限公司副总经理石晟怡11月25日称,中国国药集团已向国家药品监督管理局提交了COVID-19疫苗的上市申请,但是国家药品监督管理局药品审评中心没有公布有关COVID-19灭活疫苗上市申请的公示内容。
根据中国《国家食品药品监督管理局药品特别审批程序》,“国家食品药品监督管理局受理突发公共卫生事件应急所需防治药品的注册申请后,应当在15日内完成首轮技术审评工作”,“技术审评工作完成后,国家食品药品监督管理局应当在3日内完成行政审查,作出审批决定,并吿知申请人”。而现在在没有公布审批结果的时候,中国的疫苗已经开打,引发外界不解。这也是中国需要进一步说明的疫苗问题。
本文由看新闻网原创、编译或首发,并保留版权。转载必须保持文本完整,声明文章出自看新闻网并包含原文标题及链接。